北京大学分子医学研究所陈良怡研究组在Developmental Cell杂志在线发表胞吐-胞吞耦联新机制研究成果
2015年10月1日,北京大学分子医学研究所陈良怡研究组在Developmental Cell杂志在线发表题为“Diacylglycerol Guides the Hopping of Clathrin-Coated Pits along Microtubules for Exo-Endocytosis Coupling” 的研究成果。北京大学分子医学研究所博士生袁天一等人运用超高Z轴分辨率活细胞荧光成像技术,结合自动图像分析算法和电生理膜电容记录等方法,研究发现胰岛素分泌细胞存在新的胞吐胞吞耦联机制。
网格蛋白(Clathrin)介导的胞吞(CME)广泛存在于可兴奋与非可兴奋细胞中,进化上保守,具有重要功能。在非可兴奋细胞中,CME是一个慢速、组成型胞吞,在细胞质膜的不同位置随机发生;在可兴奋细胞中,与调节型胞吐耦联发生的CME速度很快,且发生在分泌位点附近。进化上保守的慢速CME过程是如何在神经和内分泌细胞上被加快,并且在空间上与调节型胞吐耦联在一起,是细胞生物学领域的一个基础问题。
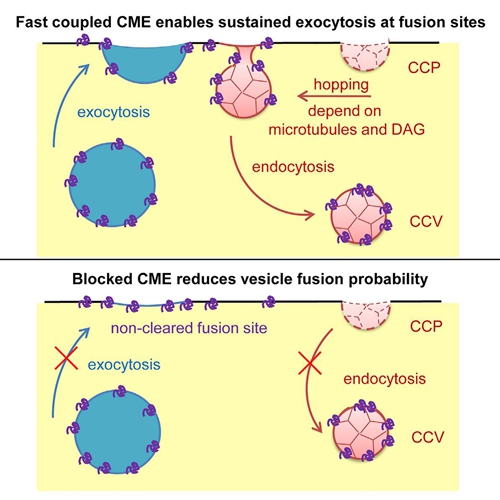
袁天一等人发现胰岛素分泌细胞的细胞膜胞吐位点附近存在预先形成的网格蛋白包裹小窝,在囊泡分泌后迅速运动到胞吐位置,然后被吞入。他们进一步证明这种可以运动的网格蛋白包裹小窝是沿着细胞膜下的微管纤维运动到胞吐的位置的。应用成像手段,他们观察到分泌发生时,具有负曲率的二酰基甘油(diaglycerol, DAG)在胞吐位置发生瞬时富集,减少局部膜张力,从而促进网格蛋白包裹小窝向胞吐位置移动。文章最后还证明,在抑制CME的情况下,多次去极化刺激导致的囊泡分泌受到明显抑制,胞吞回收囊泡膜蛋白的过程也受到显著的抑制,从而阐明了与调节型胞吐耦联的CME的重要生理功能。该工作所揭示的在细胞膜上运动的网格蛋白包裹小窝介导与调节型胞吐耦联的CME的机制,与传统细胞生物学所认为的网格蛋白包裹小窝在细胞质膜的位置是固定不动的理论截然不同。为此,同一期Developmental Cell杂志专门发表了题为“Hopping Pits Catch Fusing Granules(跳跃的小窝抓住融合的胰岛素囊泡)”的评述文章来强调介绍这一发现,并评价其“提供了分泌型细胞内胞吐和胞吞如何精确耦联的令人吃惊的重要机制”。
北京大学分子医学研究所陈良怡研究员和刘彦梅副研究员是该论文的共同通讯作者。北京大学分子医学研究所博士生袁天一、柳林、维力斯及中科院生物物理研究所张永登,为文章共同第一作者。北京大学分子医学研究所博士生赵世群、郑晓璐、黄小帅等人参与了此项研究。该研究获得了国家自然科学基金、科技部973项目、国家科技支撑计划、北京市自然科学基金和膜生物学国家重点实验室的支持。

